Попередня сторінка: Алкани: фізичні й хімічні властивості
Наступна сторінка: Виведення молекулярної формули речов�...
Пригадайте:
• формули для обчислення відносної густини газів, густини речовини та одиниці вимірювання цих величин;
• алгоритми розв'язування задач (за § 4).
Виведення молекулярної формули речовин за загальною формулою гомологічного ряду
Ви вже вмієте виводити формули сполук за відомими масовими частками елементів у них. У цьому параграфі ви навчитеся робити це, але за іншими даними.
Цей алгоритм застосовують, якщо з умови задачі відомо:
• до якого класу належить сполука, тобто відома загальна формула;
• молекулярну або молярну масу речовини.
За загальною формулою сполук можна записати рівняння для відносної молекулярної маси.
Загальною формулою алканів є CnH2n+2. Якщо молекула алкану містить n атомів Карбону, то загальна маса всіх атомів Карбону становитиме 12n (оскільки Ar(C) = 12). У цій молекулі міститься також 2n + 2 атомів Гідрогену, загальна маса яких дорівнює також 2n + 2 (оскільки АДЩ = 1). Отже, рівняння для обчислення відносної молекулярної маси алканів:
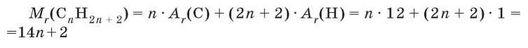
Оскільки відносна молекулярна маса та молярна маси чисельно однакові, то для алканів:

Так само можна вивести загальні формули для обчислення молярної маси сполук інших класів:

Задача 1. Визначте формулу алкану з молярною масою 72 г/моль. Розв’язання:
За умовою відомо, що сполука є алканом, тому використовуємо формулу для молярної маси алканів:
M(CnH2n + 2) = 14П + 2-
Підставляємо значення молярної маси в рівняння:
14n + 2 = 72; n = 5.
Отже, невідома сполука містить у молекулах по 5 атомів Карбону. Підставляємо число 5 у загальну формулу алканів і отримуємо молекулярну формулу C5H12.
Відповідь: формула сполуки C5H12.
Виведення молекулярної формули речовин за відносною густиною
Цей алгоритм застосовують:
• для газуватих або летких сполук;
• якщо з умови задачі відомо, до якого класу належить сполука, тобто відома загальна формула або масові частки елементів у сполуці;
• якщо відома відносна густина.
Цей тип задач нагадує задачі з попереднього підрозділу, але формулу для визначення молярної маси речовини виводимо за відносною густиною. Відносна густина газу є часткою від ділення молярних мас невідомого (В) та відомого (А) газів:

Отже, молярну масу невідомого газу обчислюємо за формулою:

Слід пам’ятати, що відносну густину можна обчислювати відносно повітря, у цьому випадку використовують середню молярну масу повітря, що дорівнює 29 г/моль.
Задача 2. Визначте формулу алкіну, відносна густина якого за гелієм становить 13,5.
Розв’язання:
Спочатку обчислюємо молярну масу алкіну за формулою (2). Оскільки відома відносна густина за гелієм, то для розрахунку використовуємо молярну масу гелію M(He) = 4 г/моль:
M(CnH2n _ 2) = M(He) ■ £He(CnH2n + 2) = 4 г/моль ■ 13,5 = 54 г/моль.
Далі використовуємо формулу для молярної маси алкінів і визначаємо сполуку:
M(CnH2n _2) = 14n - 2; 14n - 2 = 54; n = 4.
Отже, невідома сполука містить у молекулах по 4 атоми Карбону. Підставляємо число 4 в загальну формулу алкінів і отримуємо молекулярну формулу C4H6.
Відповідь: формула сполуки C4H6.
Частіше трапляються комбіновані задачі, в яких є дані про відносну густину, але невідомо, до якого класу належить речовина. Замість цього відомі масові частки елементів у сполуці. Але, використовуючи масові частки, можна вивести лише емпіричну формулу речовини — це формула, що показує співвідношення числа атомів різних елементів у сполуці. На відміну від молекулярної формули, що відображає реальний склад молекули.
У більшості неорганічних сполук емпірична та молекулярна формули співпадають, але серед органічних сполук частіше трапляється навпаки. Наприклад, молекула етану містить два атоми Карбону та шість атомів Гідрогену: молекулярна формула етану — С2Н6. Але в молекулі етану на один атом Карбону припадає три атоми Гідрогену: емпірична формула етану — СН3. І таких випадків досить багато:

У таких задачах за масовими частками спочатку визначаємо емпіричну формулу, а за відносною густиною встановлюємо молекулярну формулу.
Задача 3. Визначте молекулярну формулу вуглеводню, в якому масова частка Карбону становить 84,2 %, а відносна густина його випарів за повітрям дорівнює 3,93.
Розв’язання:
Записуємо умовну формулу вуглеводню C H . Масова частка Гідрогену: 100 % - 84,2 % = 15,8 %. Х У
Визначаємо співвідношення індексів:
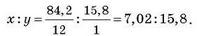
Визначаємо індекси в емпіричній формулі. Перетворюємо співвідношення так, щоб усі числа в ньому були цілими, для чого поділимо всі числа у співвідношенні на найменше серед них, у даному випадку на 7,02: x : у = 7,02 : 15,8 = 1 : 2,25, а потім помножуємо на 4: x : у = 1 : 2,25 = 4 : 9.
Отримуємо формулу C4H0, але речовини з такою формулою не існує, отже, в цьому випадку емпірична та молекулярна формули не співпадають.
За формулою (2) обчислюємо молярну масу вуглеводню за відносною густиною. Для розрахунку використовуємо середню молярну масу повітря М(повітря) = 29 г/моль:
M(CxHy) = М(повітря)• _Опов (CxHy) = 29 г/моль• 3,93 = 114 г/моль.
Якби формула речовини була C4H9, то її молярна маса дорівнювала б 57 г/ моль (12 ■ 4 + 1 ■ 9), що вдвічі менше за обчислену нами. Отже, індекси в емпіричній формулі слід помножити на 2. Отримуємо молекулярну формулу C8H18.
Відповідь: формула сполуки — C8H18.
Виведення молекулярної формули речовин за густиною
Цей алгоритм застосовують:
• для газуватих або летких сполук;
• якщо відомо, до якого класу належить сполука, тобто відома загальна формула або відомі масові частки елементів у сполуці;
• якщо відома густина газу або випарів рідини.
Замість відносної густини для виведення молекулярної формули можна використовувати й звичайну густину. Знаючи густину, можна також обчислити молярну масу речовини. Густину обчислюють, знаючи масу та об’єм речовини:

Якщо в нас є речовина кількістю 1 моль, то маса речовини такої кількості дорівнюватиме молярній масі сполуки М, а об’єм — молярному об’єму Vm. Отже,

Зверніть увагу, що в шкільному курсі ми маємо справу з об’ємами газів, виміряними за нормальних умов. У цьому разі ми можемо використовувати значення молярного об’єму, що дорівнює 22,4 л/моль. Із наведеної формули (4) видно, що густина залежить від об’єму, а отже, й від умов вимірювання. У задачах, що ми тут обговорюємо, густина випарів має бути такою, якби вона була виміряна за нормальних умов.
Отриману формулу (4) можемо використовувати для обчислення молярної маси невідомої речовини:

Задача 4. Установіть молекулярну формулу вуглеводню, в якому масова частка Карбону становить 85,7 %, а густина його випарів за нормальних умов дорівнює 3,125 г/л.
Розв’язання:
Записуємо умовну формулу вуглеводню C.H . Масова частка Гідрогену: 100 % - 85,7 % = 14,3 %.
Визначаємо співвідношення індексів:

Визначаємо індекси в емпіричній формулі. Для цього поділимо всі числа в співвідношенні на 7,14: x : у = 7,14 : 14,3 = 1 : 2.
Отримуємо емпіричну формулу CH2.
За формулою (5) обчислюємо молярну масу вуглеводню за густиною:

Якби формула речовини була CH2, то її молярна маса дорівнювала б 14 г/моль (12 + 1 ■ 2), що вп’ятеро менше за обчислену нами. Отже, індекси в емпіричній формулі слід помножити на 5. Отримуємо молекулярну формулу C5H10.
Відповідь: формула сполуки — C5H10.
Ключова ідея
Знаючи загальну формулу класу сполук, можна вивести молекулярну формулу речовини за молярною масою. Якщо загальна формула невідома, використовують інші дані, з яких можна дізнатися про співвідношення числа атомів у молекулах.
Завдання для засвоєння матеріалу
101. Виведіть формулу для обчислення молярної маси алкенів, алкінів, аренів та спиртів.
102. Визначте молекулярні формули для таких речовин:
а) алкан, М = 44 г/моль; б) алкен, М = 70 г/моль; в) алкін, М = 54 г/моль; г) арен, М = 92 г/моль; д) спирт, М = 74 г/моль.
103. Визначте молекулярну формулу алкену, відносна густина якого за вуглекислим газом дорівнює 2,55.
104. Визначте молекулярну формулу арену, відносна густина якого за метаном дорівнює 6,625.
105. Визначте молекулярну формулу вуглеводню, масова частка Карбону в якому становить 0,75, а відносна густина його випарів за повітрям дорівнює 0,552.
106. Визначте молекулярну формулу вуглеводню, масова частка Карбону в якому становить 80 %, а його густина за нормальних умов дорівнює 1,342 г/л.
107. За даними хімічного аналізу, кількісний склад речовин А та Б приблизно однаковий. Речовина А містить: Карбон — 51,89 %, Гідроген — 9,73 %, Хлор — 38,38 %. Відносна густина випарів речовини Б за повітрям приблизно у два рази більша, ніж у речовини А. Визначте речовини А та Б. Чи має ця задача однозначну відповідь?
108. Визначте молекулярну формулу вуглеводню, масова частка Карбону в якому становить 85,7 %, а відносна густина його випарів за повітрям дорівнює 1,93.
109. Визначте молекулярну формулу речовини, в якій масова частка Карбону становить 80 %, Гідрогену — 20 %, а відносна густина за воднем дорівнює 15.
110. Визначте структурну формулу вуглеводню, масова частка Карбону в якому 81,82 %, а густина дорівнює 1,964 г/л.
111. Масова частка Карбону у вуглеводні становить 85,7 %. Густина його випарів за повітрям дорівнює 1,45. Визначте число атомів Карбону в одній молекулі цього вуглеводню.
112. Визначте молекулярну формулу вуглеводню, в якому масова частка Карбону становить 88,2 %, а густина його випарів за нормальних умов дорівнює 3,036 г/л.
113. Визначте молекулярну формулу вуглеводню, в якому масова частка Карбону становить 88,09 %, а густина його випарів за нормальних умов дорівнює 7,5 г/л.
Це матеріал з підручника Хімія 10 клас Григорович
Наступна сторінка: Виведення молекулярної формули речов�...